國家藥監(jiān)局:這30個藥,可直接申請上市
日期:2019/5/11
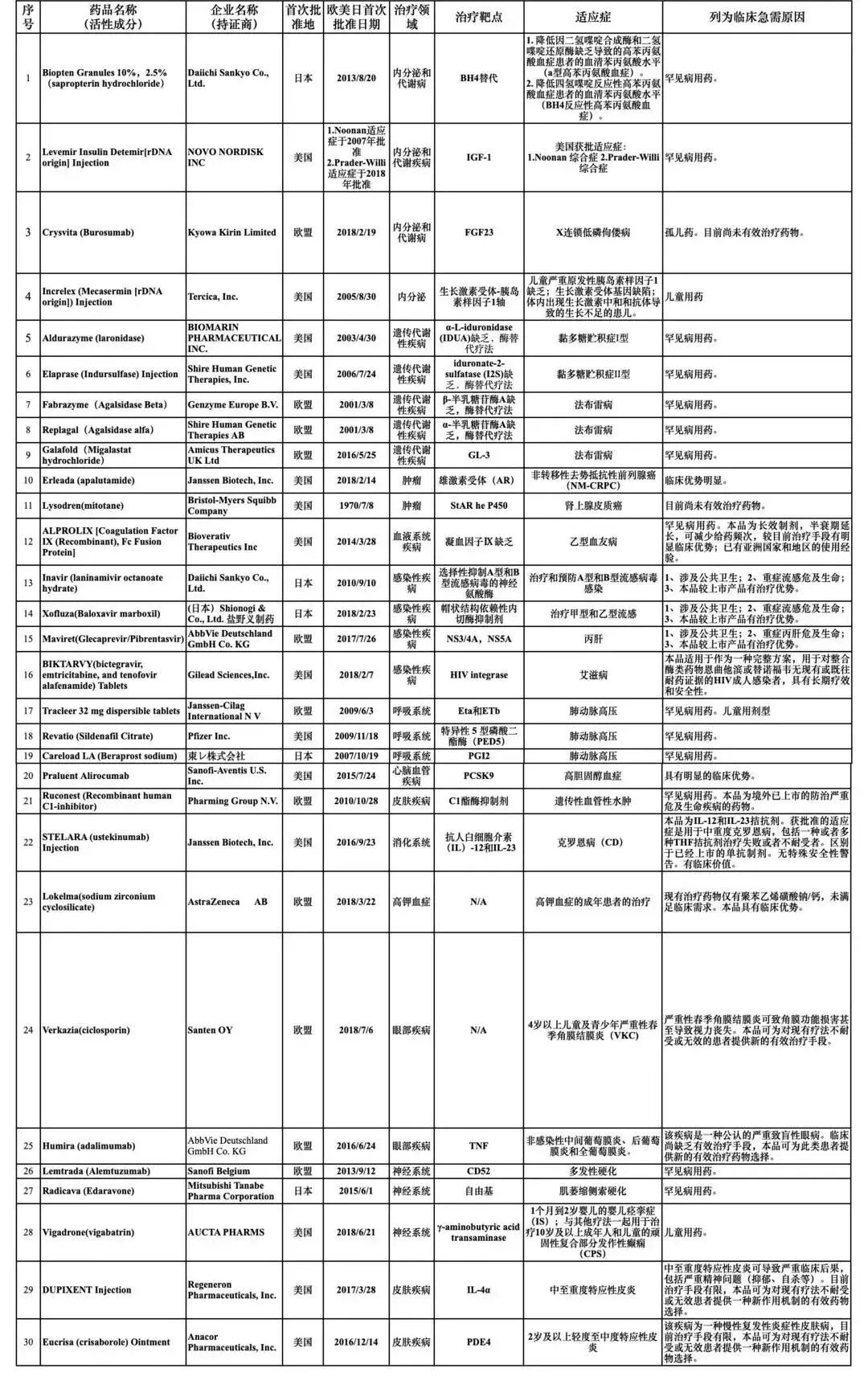
近日,國家藥監(jiān)局藥品審評中心(下簡稱藥審中心)發(fā)布《關(guān)于第二批臨床急需境外新藥的公示》,共涉及22家藥企的30個藥品。

這些藥,越來越受關(guān)注
根據(jù)通知,此次名單中的30種藥品中,首次批準(zhǔn)地集中在歐盟、美國和日本。其中,14種藥品為罕見病用藥,包括治療法布雷病(Fabry)的Fabrazyme(Agalsidase Beta),治療肺動脈高壓的Revatio(Sildenafil Citrate)、治療肌萎縮側(cè)索硬化(ALS,俗稱“漸凍人癥”)的Radicava (Edaravone)等。
這是藥審中心在短短的五個月內(nèi),第二次發(fā)布臨床急需境外新藥。早在2018年11月1日,藥審中心就曾發(fā)布了第一批臨床急需境外新藥名單,共有48個藥品。其中,罕見病用藥共有23個品種在列。
罕見病,是指那些發(fā)病率極低的疾病,稱“孤兒病”,根據(jù)世界衛(wèi)生組織(WHO)的定義,罕見病為患病人數(shù)占總?cè)丝诘?.65%~1%的疾病。
據(jù)了解,截至目前,美國FDA批準(zhǔn)的罕見病藥物中,有259種在我國未上市。
從第一批、第二批名單,以及2018年以出臺的政策來看,目前罕見病用藥在我國越來越受關(guān)注。
2018年5月,國家衛(wèi)健委等5部委聯(lián)合發(fā)布的《第一批罕見病目錄》,將肌萎縮側(cè)索硬化、白化病、戈謝病等121種罕見病納入其中,并于2019年2月27日發(fā)布《罕見病診療指南》,對121種罕見病進(jìn)行系統(tǒng)的梳理,提供給各級臨床醫(yī)務(wù)人員學(xué)習(xí)和規(guī)范罕見病診療。
根據(jù)國家藥監(jiān)局2018年10月23日出臺的《臨床急需境外新藥審評審批工作程序》,在審評方面,藥審中心將建立專門通道開展審評,對罕見病治療藥品,在受理后3個月內(nèi)完成技術(shù)審評;對其他境外新藥,在受理后6個月內(nèi)完成技術(shù)審評。
壹基金官網(wǎng)顯示,截至2018年12月,《第一批罕見病目錄》中共有74種罕見病是“有藥可治的”,且這74種罕見病已在美國或歐盟、日本上市162種治療藥物,但其中僅有83種在中國上市,涉及53種罕見病。
然而,在中國明確注冊罕見病適應(yīng)癥的藥物僅有55種,涉及31種罕見病。在這55種藥物中,僅有36種藥物涉及23種罕見病已被納入醫(yī)保目錄。
隨著一系列政策落地,那些在發(fā)達(dá)國家獲批上市,具有明確療效的罕見病用藥,將越來越多的被引進(jìn)中國,填補市場空白。
下一個風(fēng)口,經(jīng)典藥物新用
一個新藥的發(fā)現(xiàn),需要承擔(dān)高額的投入和未知的風(fēng)險,據(jù)統(tǒng)計,研發(fā)新藥并成功上市需耗時13~15年,平均花費20億~30億美元,而隨著對藥物安全性及有效性的要求不斷提高,開發(fā)新藥的成本還將持續(xù)上漲。
由于罕見病患者人數(shù)少,加上治療藥物研發(fā)周期和成本都較一般藥物高,藥企大多動力不足,目前全球只有極少數(shù)的罕見病擁有有效治療藥物。
藥物研發(fā)成本高企,對每個病人來說,需要承擔(dān)的藥費就更高。
在今年“兩會”上,全國政協(xié)委員、香港食物及衛(wèi)生局原局長高永文提到,在香港,罕見病病人一年的藥費可能高達(dá)幾百萬元。
此前有媒體曾報道,患者一旦被確診患上罕見病后,多年攢下的積蓄很快化作一粒粒藥丸。在罕見病的藥物尚未納入醫(yī)保時,一天能吃掉一部iPhone6。
據(jù)健康報報道,目前全球預(yù)計有超過3億罕見病患者,中國有1680 多萬人。已經(jīng)明確的罕見病有7000 多種,其中80%為遺傳病,如白化病、血友病等,95%的罕見病仍沒有特效藥。國外著名罕見病慈善機構(gòu)Findacure介紹,如果按照現(xiàn)在的藥物發(fā)展速度,讓罕見病患者用上創(chuàng)新藥需要等500年。
因此,國際罕見病慈善機構(gòu)已聯(lián)合發(fā)起了“罕見病經(jīng)典藥物新用的公開呼吁”。
相比新藥而言,經(jīng)典藥物由于藥動學(xué)以及安全性資料較為詳盡,對其新用途的開發(fā)能很快進(jìn)入Ⅱ期臨床評估,使研發(fā)周期縮短至3~12年。
事實上,臨床上也有不少經(jīng)典藥物被研究成為“新藥”的例子。
例如,有著百年歷史的阿司匹林,其適應(yīng)癥由最初的解熱鎮(zhèn)痛,逐漸擴展到偏頭痛、抗血栓等;
達(dá)泊西汀最初主要作為鎮(zhèn)痛和抗抑郁藥物,卻在2009年被美國FDA批準(zhǔn)用于治療早泄,成為治療早泄的第一款口服藥物;
導(dǎo)致海豹肢的沙利度胺,最初的適應(yīng)癥是治療孕吐,隨著不斷的研究,在1998年被美國FDA批準(zhǔn)沙利度胺治療麻風(fēng)結(jié)節(jié)性紅斑的治療,在2006年再被批準(zhǔn)用于治療多發(fā)性骨髓瘤。
這樣的例子還有很多。而在罕見病用藥方面,也已有類似的嘗試。
位列于本次國家藥監(jiān)局公布的《第二批臨床急需境外新藥》,治療ALS(“漸凍人癥”)的Edaravone(依達(dá)拉奉),此前其實是腦卒中的經(jīng)典治療藥物。
依達(dá)拉奉是日本三菱制藥公司研制的新藥,2001年上市后迅速成為腦卒中治療的一線藥物。并受到日本腦卒中診治指南推薦使用。2015年該產(chǎn)品在日本獲批ALS新適應(yīng)癥。2017年5月,美國FDA批準(zhǔn)了依達(dá)拉奉作為“漸凍人癥”治療藥物上市銷售,這是繼利魯唑后,唯一獲批治療該疾病藥物。
截至目前,依達(dá)拉奉已經(jīng)先后在日本、韓國、美國、加拿大四個國家獲批用于ALS的新適應(yīng)癥。類似的經(jīng)典藥物新用,特別是在罕見病領(lǐng)域,正在越來越受到重視。
據(jù)了解,依達(dá)拉奉于2004年在中國上市,作為腦卒中治療藥物已被寫入國內(nèi)相關(guān)指南,并納入醫(yī)保范圍,且相較于利魯唑的高自費價格,能減輕患者負(fù)擔(dān)。因此,業(yè)內(nèi)專家對依達(dá)拉奉在國內(nèi)治療ALS的前景持樂觀態(tài)度。
隨著罕見病用藥相關(guān)政策逐漸落地,臨床研究的不斷深入,罕見病領(lǐng)域的經(jīng)典藥物新用,將有望成為下一個風(fēng)口。
附:臨床急需境外新藥名單(第二批)
(點擊放大查看)
BY/
來源:賽柏藍(lán)
|